헷갈리는 유전자 치료제, 졸겐스마, 카스거비 뭐가 다른가요?
최근 유전자 치료(Gene Therapy)에 대한 관심이 매우 높습니다. 간단하게 말해서 유전자 치료란 환자의 유전자를 바꿔서 유전병을 치료한다는 것인데요. 특히 2020년 CRISPR/Cas9 유전자 가위법이 노벨상을 수상한 후 더 관심이 높아졌고, 이 유전자 가위 방법을 사용한 카스거비(Casgevy, 상품명 엑사셀)가 겸상적혈구증(낫적혈구증) 치료제로 영국에서 첫 승인을 받은 것이 지난 주에 크게 뉴스(아래 링크)가 되었지요. 오는 12월에 미국 FDA에서도 허가가 날 것이라는 예측이 많습니다.
https://www.hani.co.kr/arti/science/science_general/1116973.html
노벨상 ‘유전자 가위’, 질병 치료 문 열었다…수십억 비용 걸림돌
크리스퍼 유전자 가위, 영국서 ‘겸상 적혈구병’ 등 첫 승인환자 아프리카계 많아서 고비용 부담…부작용 추적 필요
www.hani.co.kr
그런데 이번 주에 역시 크리스퍼 유전자 편집 기술을 이용한 콜레스테롤 저하제 VERVE-101에 대한 중간 임상발표 뉴스(아래 링크)가 있었는데, 많은 분들이 이 두 가지 방법의 차이를 잘 모르시는 것 같습니다. 실은 저도 처음 기사를 볼 때는 좀 헷갈렸었는데, 두 치료제는 완전히 다른 방식의 치료제입니다. 그래서 오늘은 유전자 치료에 대한 기본 개념을 간단히 설명해볼까 합니다.
https://www.hani.co.kr/arti/science/science_general/1117502.html
주사 한 방으로 ‘유전자 편집’…평생 콜레스테롤 고민 끝낸다
첫 체내 유전자 편집 임상시험 결과혈중 콜레스테롤 수치 절반 감소 비가역적 유전자 변화·부작용 ‘걸림돌’
www.hani.co.kr
그 전에 우리가 알면 좋을 약이 하나 더 있는데, 소위 "20억짜리 치료제"로 화제를 모았던 졸겐스마입니다. 졸겐스마는 노바티스의 척수성근위축증(SMA) 유전자치료제인데 최근 보험급여가 가능해졌다는 기쁜 소식이 있었죠 (아래 링크). 자, 이 세가지 약은 어떤 차이가 있을까요?
https://news.mt.co.kr/mtview.php?no=2023070314403164037
20억 원샷 치료제, 598만원에…희귀병 아이 5명 살렸다 - 머니투데이
심평원, '졸겐스마' 1차 성과 평과 공개환자 6명 중 5명 성공… 1명은 사망으로 실패5년간 6개월마다 효능 평가… "고가약 성과 관리 대상 늘릴 것"1회 투여 비용이 20억원에 달하는 초고가 약제 '졸
news.mt.co.kr
일단 유전자 치료는 문제가 있는 유전자를 바꿔서 치료한다는 측면에선 동일하지만 크게 두가지 카테고리로 나눌 수 있습니다. 하나는 바뀐 유전자를 바로 주사하는 방법(In vivo법), 다른 하나는 환자 몸에서 세포를 꺼내서 유전자를 바꾼 후 그 세포를 다시 넣어주는 방법 (Ex vivo 법)입니다. 위에서 언급한 졸겐스마는 in vivo 치료법이고 카스거비는 ex vivo 법이죠.

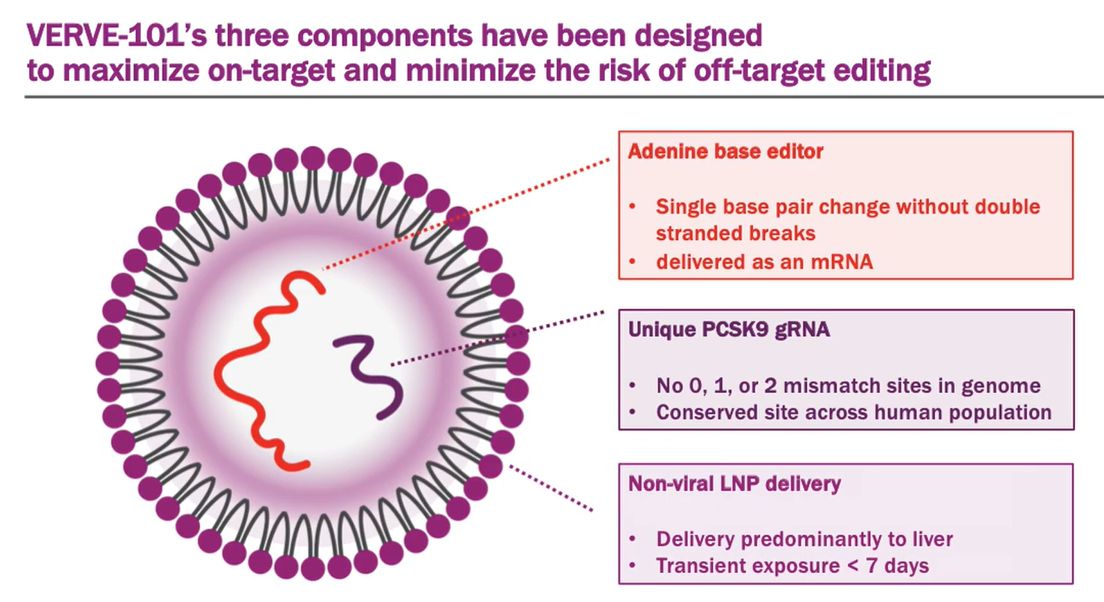
그런데 가장 최근에 뉴스에 나온 verve-101은 어떤 방법일까요? 이건 또 다른 방식인데 유전자를 주사하는 것이 아니라 유전자 가위를 주사해서 바꾸는 방법(Gene editing 방법?)입니다. 아래 FDA의 설명 그림을 보시면 맨 왼쪽에 nuclease (가위)들을 도입하는 방식을 소개하고 있는데 하나 하나 살펴보죠.

1. In vivo 유전자 치료법: 바뀐 유전자를 넣는 방법
In vivo 유전자 치료법은 치료 유전자(타겟 유전자의 수정본)를 바로 주사합니다. 그리고 그 치료 유전자가 원하는 부위의, 원하는 세포에 제대로 들어가야 하죠. 이를 위해 유전자 전달 벡터를 사용하는 것이 중요합니다. 보통은 non-pathogenic 바이러스 벡터에 타겟 유전자를 끼워 넣어 사용하거나 코로나19 백신에서 봤듯이 LNP (lipid nanoparticle)을 사용합니다.
이 방법의 장점은 ex vivo 유전자 치료법처럼 번거롭지 않고 상대적으로 간단하다는 것입니다. 제품으로 만들어서 바로 팔 수도 있죠. 하지만 단점이 있는데 소위 ʻ오프 타겟(off-target) 문제입니다. 우리 몸 속의 예상 못한 곳에 유전자가 끼어들어가거나 예상 못한 위치에서 유전자가 발현되면 문제가 될 수도 있습니다. 그걸 확인하기도 어렵고 바로잡기도 어렵구요. 물론 오프 타겟에 대한 대비가 나름 되어 있으니까 제품으로 나왔겠죠.

2. Ex vivo 유전자 치료법 (또는 ex vivo 세포 치료법): 바뀐 유전자가 있는 세포를 넣는 방법
Ex vivo 유전자 치료법은 환자로부터 특정 세포를 얻은 후, 체외에서 세포안에 유전자를 바꿔주고 제대로 바뀌었는지 확인한 후에 그렇게 조작된 세포를 환자에게 다시 넣어주는 방식입니다. 일종의 환자 맞춤형 방법이라고 할 수 있죠. 이 방식은 유전자를 바꿔주는 방식이긴 하지만 사람 몸에 주입하는 것은 세포이기 때문에 세포 치료법 (cell therapy)라고도 할 수 있습니다.
이 방식의 가장 큰 장점은 앞서 이야기한 오프 타겟 문제를 획기적으로 줄일 수 있다는 것입니다. 왜냐하면 유전자 조작 과정 중에 생길 수 있는 문제점을 확인한 후에 세포내에 주입하기 때문이죠. 또한 혹시 모를 바이러스 전달체에 의해 유발될 수 있는 면역반응도 줄일 수 있습니다.
그런데 위의 카스거비(Casgevy, Exa-cel)는 유전자를 바꿔줄 때 크리스퍼 방식을 사용했다는 것입니다. 위의 2013년도 논문 그림에서는 역시 바이러스 벡터를 사용해서 세포 안에 유전자를 넣어줬는데, 그 이후 크리스퍼/캐스9 방법이 개발되었고 카스거비는 새로운 방식으로 유전자를 바꿔준 것이죠.

그런데 유사한 방식의 세포 치료법으로 최근 크게 각광받는 CAR-T 세포치료제가 있고, 노바티스가 최초로 개발한 '킴리아(Kymriah, tisagenlecleucel-T)'가 유명하죠. CAR-T세포란 Chimeric Antigen Receptor-T cell의 준말인데, 암세포 표면의 특이적 항원과만 결합하도록 유전자 재조합을 통해 만든 T세포를 뜻합니다. 이미 CAR-T세포 치료제 업체들도 크리스퍼 기술을 이용해서 CAR-T세포를 만들고 임상이 시작되었다고 합니다.

3. Gene Editing 유전자 치료법(?):유전자 가위를 넣어 바꾸는 방법
이 방법은 아직 명확한 이름이 붙여지지 않았는데 새로운 명명이 필요해 보입니다. 이 방식과 위의 두가지 방법과 가장 큰 차이점은 주사를 통해 넣어주는 것이 바뀐 유전자 (또는 세포)가 아니라 가위를 넣어준다는 것입니다. 즉 위의 두가지 방법은 유전자 가위를 사용하든 않든 타겟 유전자 또는 타겟 유전자가 들어간 세포를 가지고 치료하는데 반해서, 이 gene editing 방법은 아예 환자 몸에다가 유전자 가위(CRISP/Cas)를 주사해서 몸 안에서 타겟 유전자의 변형(교정)이 일어나게 만드는 방식인 거죠.
몸 안에서 알아서 유전자 편집이 일어나다니, 그 방법이 가능하겠냐구요? 쉽지 않아보이긴 합니다만, 사실 유전자 치료라는 개념이 처음 나올 때(제 대학원 시절)를 생각해보면 in vivo건 ex vivo건 다 불가능해보였고 훨씬 더 비관적이었는데 여기까지 왔지 않습니까? 미래를 누가 감히 예측할 수 있을까요?
물론 verve-101의 임상 1상에서 사망자가 나왔고 심장마비도 있었기에 과연 gene editing 방식이 앞으로 어떻게 진행될지 알 수는 없으나 관심을 갖고 지켜볼 수 밖에 없을 듯합니다. 하지만 GMO 가지고 그렇게 난리를 치던 세상에서 갑작스레 사람 몸에 유전자를 막 찔러 넣는 세상으로 바뀌는 것을 보는 기분은 참 묘합니다.ㅎㅎ
참 미국 FDA에서 허가한 유전자(세포) 치료제 목록도 참고하세요.ㅎㅎ
Approved Cellular and Gene Therapy Products
Listing of licensed and approved products from the Office of Tissues and Advanced Therapies (OTAT).
www.fda.gov